近日,南方科技大学生物医学工程系张华威等科研人员在Nature Communications杂志上以“Cryo-EM structure of human heptameric pannexin 2 channel”为题发表研究论文,报道泛连蛋白Pannexin 2 (Panx2)的冷冻电镜结构及工作机制。
泛连蛋白(Panx)可形成大孔非选择性的膜通道,包括Panx1、Panx2及Panx3三类成员。Panx2可介导相邻细胞之间或者细胞与细胞外基质之间的物质交换,转运ATP及钙离子等小分子,在细胞通讯和细胞稳态中发挥重要作用。Panx2的功能异常可导致缺血性脑损伤、神经胶质瘤和多形性胶质母细胞瘤等多种疾病。相对于Panx1及Panx3,Panx2 有着较长的序列和独特的C端结构域,对Panx2的结构研究可为 Panx家族工作机制提供新见解。
在本项工作中,研究人员通过一系列表达条件及纯化条件的筛选,得到适合冷冻电镜研究的Panx2样品,在南科大冷冻电镜中心进行冷冻条件的筛选及数据收集工作,并最终获得分辨率为3.4 Å的Panx2通道结构(图1)。Panx2 由七个相同的亚基组成,它们围绕跨膜通道以七重对称的方式进行组装。每个亚基可分为三个结构域:胞外结构域 (ECD)、跨膜结构域 (TMD) 和胞内结构域 (ICD)。其中胞外结构域中的Q91、E102、S264及Y94残疾分别与相邻亚基的Y82、Q285、Y82及S278残疾形成相互作用位点,胞内结构域中的CH1 和 CH3螺旋分别与相邻亚基的CH6 和 CH7螺旋相互作用,这些位点共同形成了Panx2七聚体的结构基础。
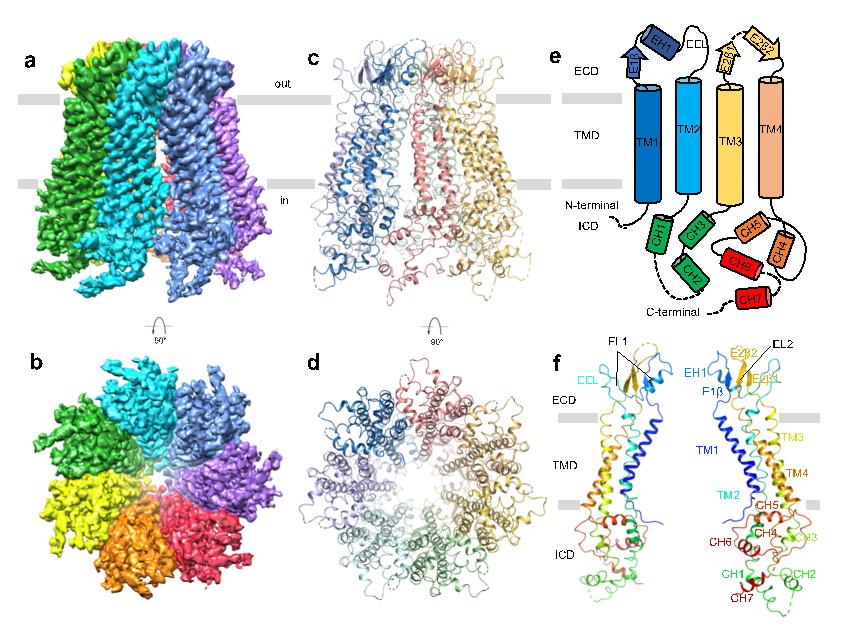
图1. Panx2冷冻电镜结构
通过Panx2与Panx1的结构比对分析、Panx2通道半径分析以及Panx2通道静电情况分析,研究人员推测本项目获得的Panx2结构处于开放状态。位于细胞外入口处的七个R89精氨酸残基组成的环形成通道的最窄部位,作为调控底物选择性的分子过滤器。这些观察得到分子动力学模拟及ATP 释放实验的进一步验证 (图2)。本研究加深了人们对 Panx2 通道的认识,也为理解Panx家族的工作机制提供新的见解。
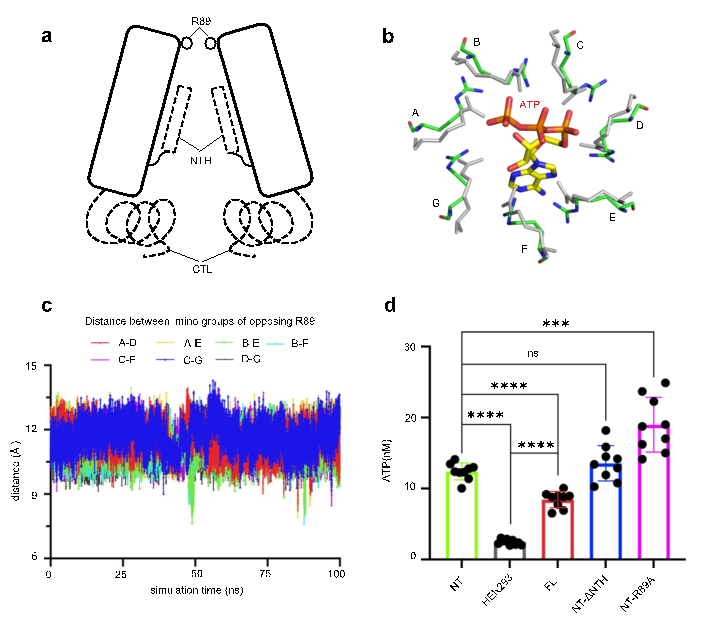
图2. R89残基调控Panx2通道的开闭
生物医学工程系博士后张行博士为本文第一作者,张华威副研究员及中科院深圳先进技术研究院的袁曙光教授为本文通讯作者。南方科技大学为本文第一单位及通讯单位。本项目得到国家自然科学基金委员会、深圳市科技创新委员会、南方科技大学冷冻电镜中心等单位在资金及技术方面的支持。
论文链接:https://www.nature.com/articles/s41467-023-36861-x