单分子定位显微镜(single-molecule localization microscopy, SMLM)具有纳米级的超分辨能力,已成为结构细胞生物学研究的重要手段。其中多通道的SMLM的各种扩展应用至关重要,因为它们极大地增加了可以从样本中提取的信息量:用不同颜色的荧光团标记的蛋白质多色SMLM成像可以探测它们的空间关系和相互作用。通常使用两个光谱通道[1-3]或一个空间通道与另一个光谱检测通道相结合来实现[4]。使用两个或多个探测通道的三维(3D)SMLM技术,例如双平面[5]或多平面探测[6]、自弯曲点扩散函数[7]、超临界角度荧光探测[8,9]、多相位干涉[10,11]、多通道荧光偏振[12]等,在研究生物结构的内在三维空间组成方面发挥重要作用。
2022年6月7日,南方科技大学李依明副教授、欧洲分子生物学实验室Jonas Ries研究员课题组合作在Nature Communications上发表了题为“Global fitting for high-accuracy multi-channel single-molecule localization”的研究。提出一种基于GPU加速的多通道全局拟合算法globLoc,用于三维单分子定位,它可以从多通道单分子数据中提取最大信息,提高了双平面和4Pi-SMLM的定位精度,并改善了比率多色三维SMLM的颜色分类。

与单通道SMLM相比,多通道的数据分析相对比较复杂,因为必须把两个或多个通道结合起来才能得到额外的信息(颜色、z位置、偏振状态、干涉相位等)。传统的方法是首先在每个通道中分别拟合荧光团以提取相应的参数,然后组合从不同通道返回的参数来获得额外信息。单个荧光团在多个通道中的单独拟合不是最佳的,因为忽略了高度相关的信息(例如三维位置和光子等)。相反,如果我们使用一个全局拟合器来链接不同通道中的相关参数,这将减少拟合参数的数量,提高拟合的精度和鲁棒性,并避免不同通道中相应参数配对时引发的不确定性。因此,研究人员开发了多通道全局拟合方法globLoc,并设计了一个通用的数据分析工作流程,方便使用软件对不同通道中检测到的单分子数据进行全局拟合。其优化的分析流程包括: 生成通道之间的转换映射关系,校准全局多通道PSF,基于GPU的全局拟合器实现快速和精确定位,以及后处理程序提取额外的信息(z位置,颜色,干涉相位,偏振等)。在仿真和实验数据中,研究人员发现全局拟合能够显著提高双平面和4Pi-SMLM的定位精度以及多色SMLM的颜色分类。
以双通道为例对全局拟合分析流程(图1)进行说明。首先对盖玻片表面的荧光珠在Z方向进行扫描,并单独计算每个通道的样条PSF模型[13],再分别用相应的样条PSF模型对每个通道进行拟合,以获得精确的荧光珠位置。从两个通道中对应的珠子位置,计算出通道之间的映射关系。然后使用三次多项式插值来对大量的荧光珠进行配准和平均,同时保持映射过程中通道之间固定的空间关系。此外,也可以使用相应的PSF模型分别对每个通道中的单分子数据进行分析,并根据拟合的坐标计算映射关系。除了使用实验型的PSF模型,还支持用高斯PSF模型进行全局拟合。在校准多通道PSF模型和不同通道之间的映射关系之后,最后进行全局拟合,使用极大似然估计(maximum likelihood estimation,MLE)联合分析多通道数据。
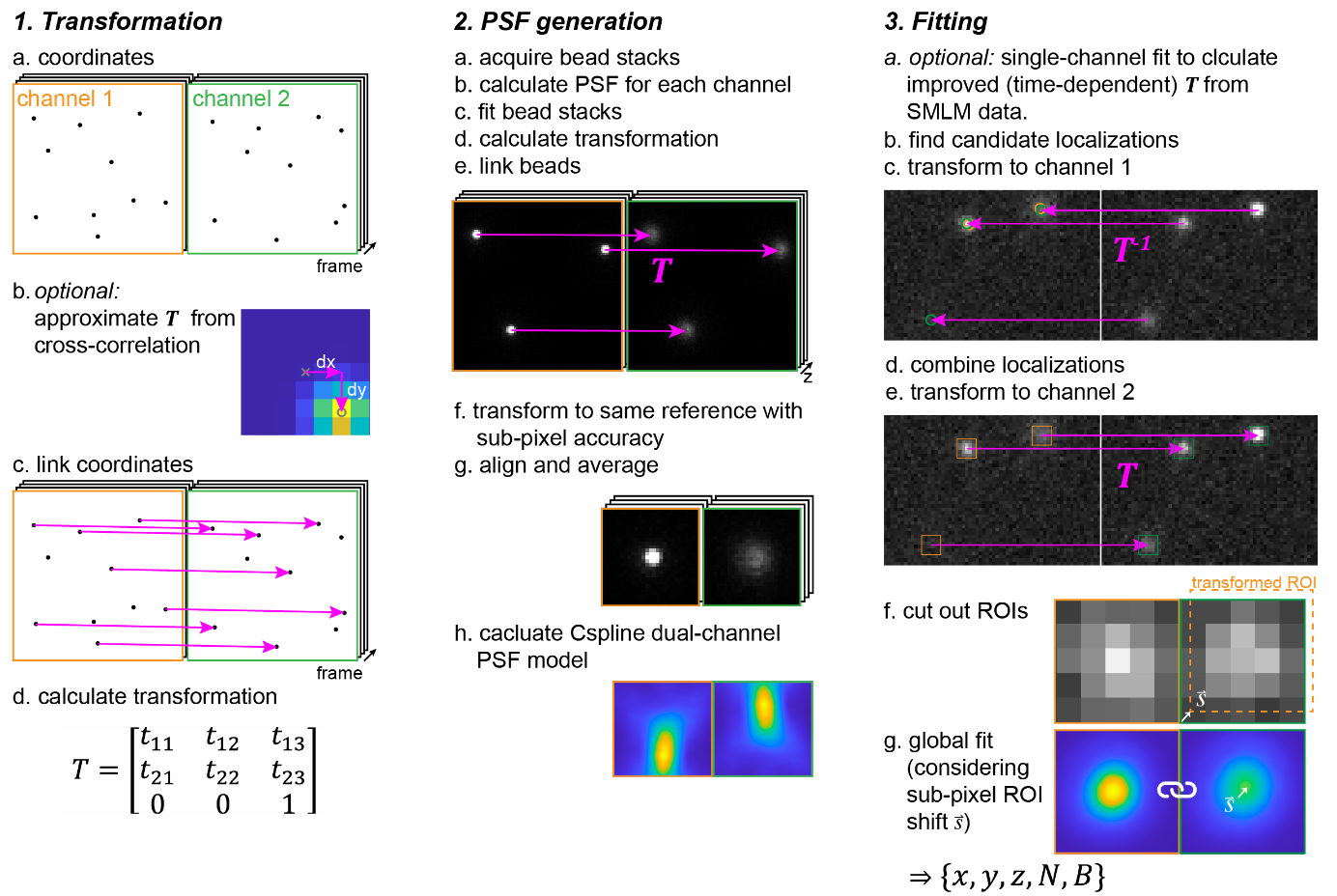
图1 多通道全局拟合方法的工作流程概述。
(图源:Yiming Li, et al., Nat Commun, 2022)
由于globLoc可以灵活地链接不同通道之间的参数,研究人员比较了在单独拟合,全局拟合下对链接XYZ位置和链接XYZ以及发射光子情况下的定位精度。与拟合单独通道然后对位置进行Cramer-Rao-Lower-Bound(CRLB)加权平均相比,globLoc提高了大约1.5倍的z定位精度(图2a)和更加鲁棒的参数估计。这一分辨率的提高通过参加持续举办的2016 SMLM Software Challenge得到了进一步证实,在该挑战赛中,globLoc在双平面数据上的3D定位精度比其他表现最好的算法LEAP提高了近两倍(图2b)。对训练数据集(模拟微管),与主要的SMLM分析软件ThunderSTORM (图2c)相比,有了明显的改善。对核孔复合体(nuclear pore complex,NPC)上标记的Nup96蛋白质实验数据结果显示,globLoc相比ThunderSTORM改善更为明显,globLoc能够清晰地解析NPC的双层环状结构(图2d)。
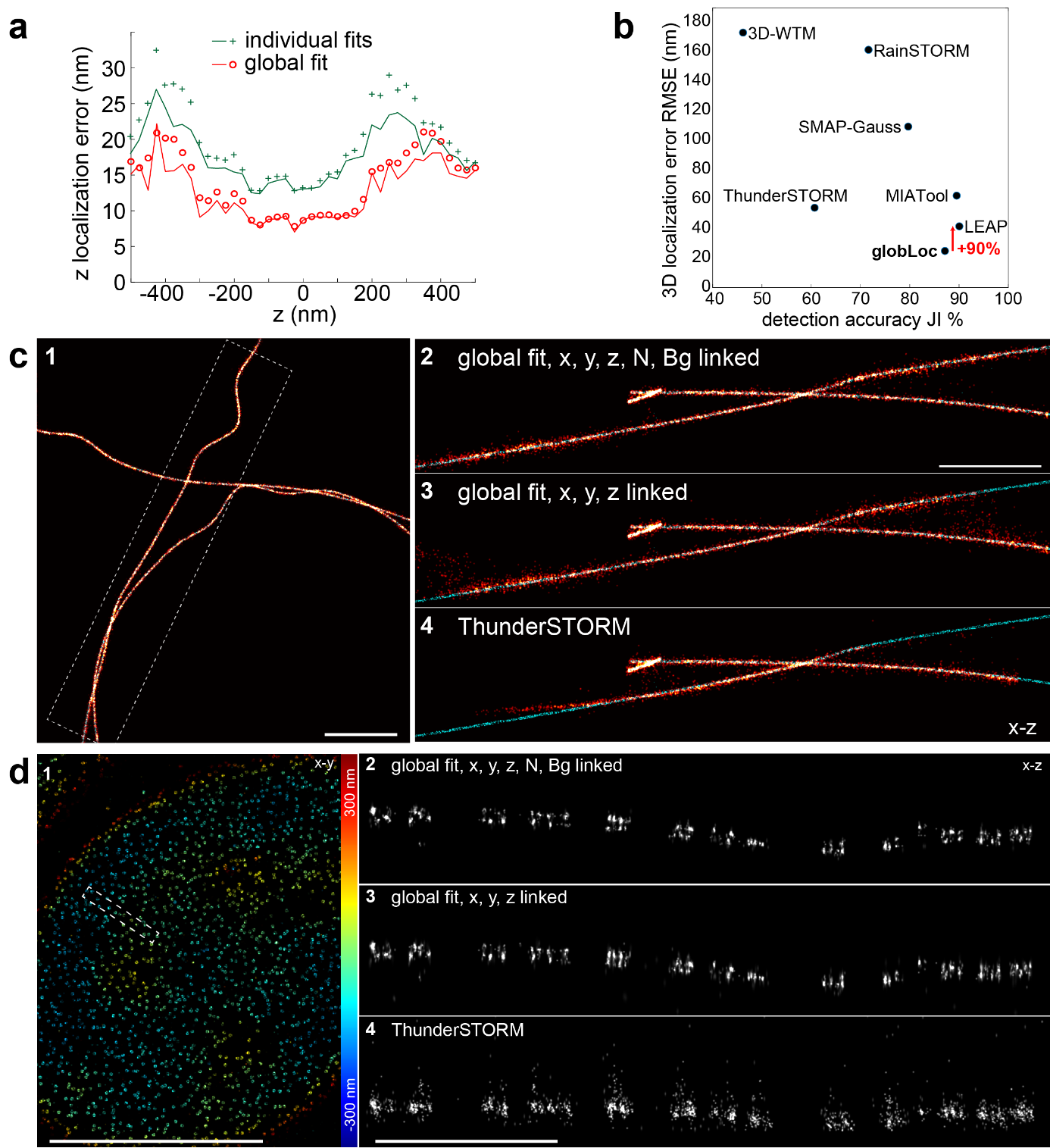
图2 globloc用于分析双平面数据
(图源:Yiming Li, et al., Nat Commun, 2022)
globLoc不限于双通道的数据分析,研究人员利用实验4Pi-PSF模型[14],对具有多相位干涉的4Pi-SMLM进行四通道拟合。通过使用样条插值实验PSF模型对所有四个相位图像进行全局拟合,globLoc在所有维度上都实现了定位精度逼近CRLB。并且与当前主要的分析方法相比,精度和准确性都大大提高(图3a)。在4Pi-SMLM实验数据上,对比在核孔复合体中Nup96八聚体的团簇重建结果,globLoc在所有参数链接的情况下重建出来的团簇相比于当前主要的分析方法(photometry)和不链接光子的globLoc重建的团簇更小(图3b),更接近真实样品结构。
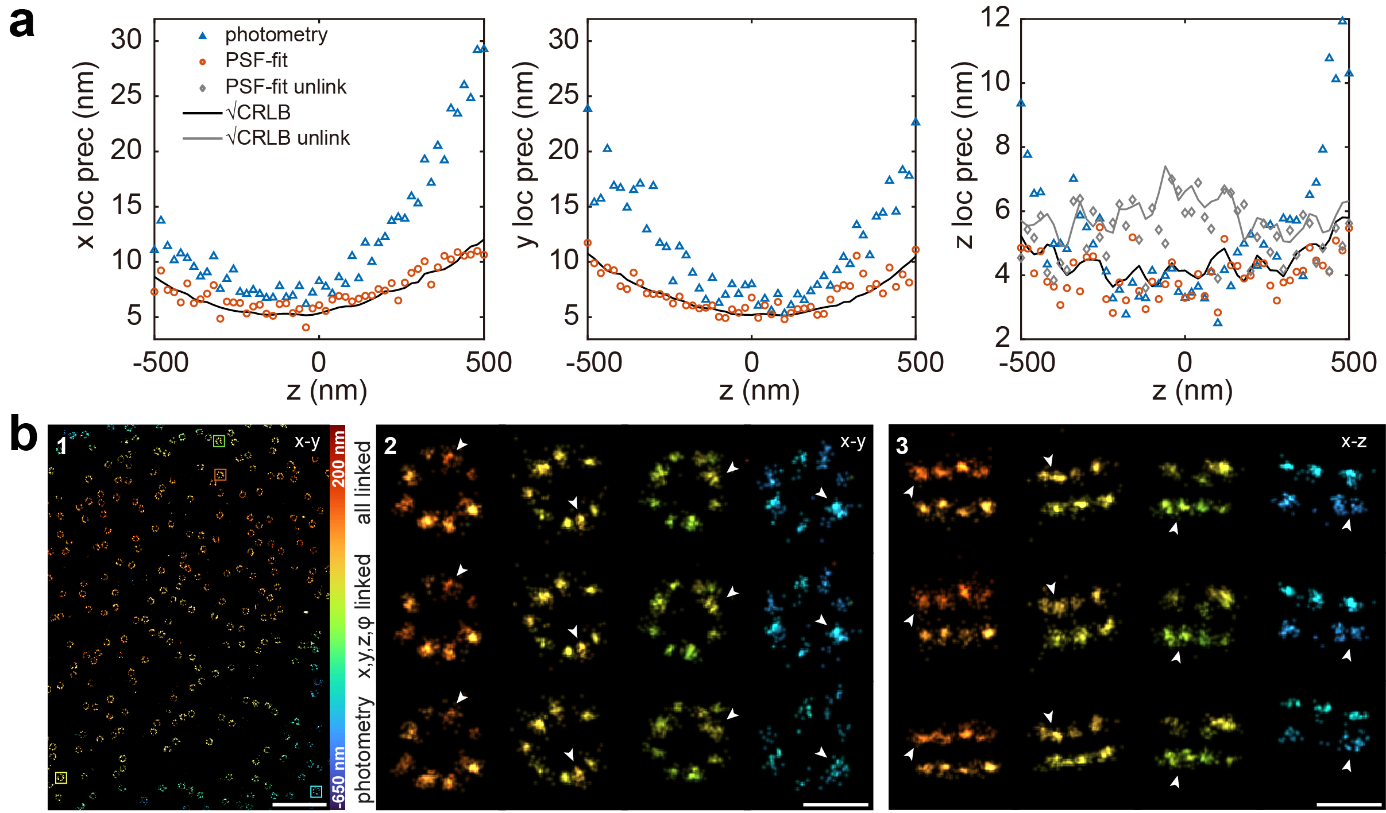
图3 globloc用于分析4pi-smlm数据
(图源:Yiming Li, et al., Nat Commun, 2022)
globLoc的全局拟合对具有重叠发射光谱的多种染料进行成像分析,根据在每个通道中检测到相对光子数量区分单个分子的颜色(图4a)。globLoc提高了定位光子数的准确性,从而在模拟和实验中提高了颜色分类的准确性(图4b) ,同时利用综合利用了所有检测到的光子进行定位,没有造成光子数的损失。globLoc的这些创新使得在比率分色3D SMLM(图4C)中首次对四种染料同时成像并准确地区分出四种颜色。实验验证中采用AF647、DY634、CF660C和CF680染料对单个NPC的Nup96、Nup62、Elys和WGA蛋白标记后的成像结果显示,四种颜色没有明显的串扰。研究人员对200个NPC图像进行了平均,得到了四种NPC蛋白质的平均后的结构位置,其中 Nup96 形成两个具有八聚体对称性的环,Elys形成一个大环,Nup62和WGA位于圆环的中央通道。值得注意的是,这些是荧光团的平均分布,由于抗体大小及其非随机方向可能会引起的连接错误而导致的表位的分布不同。
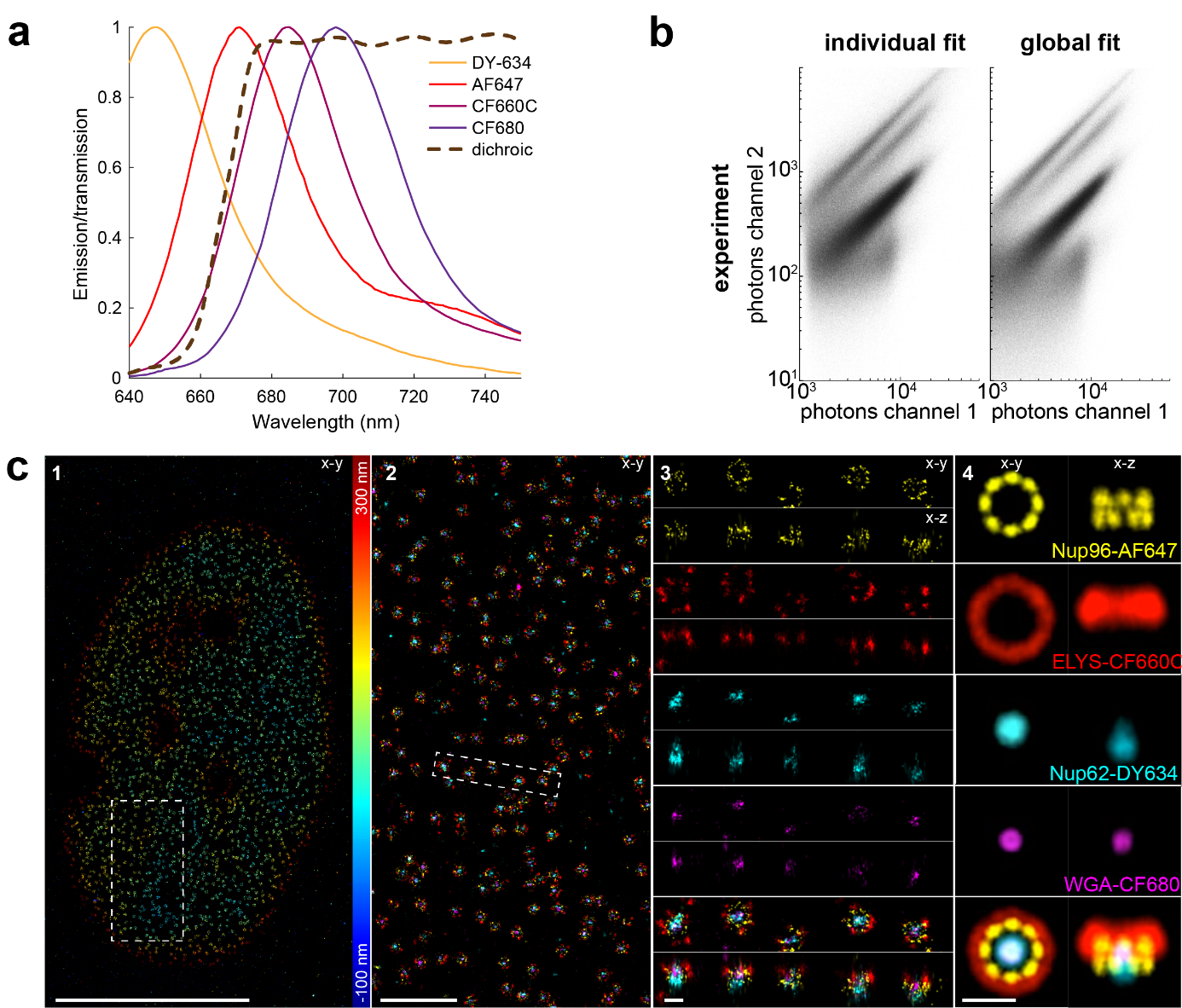
图4 globloc用于分析多色数据
(图源:Yiming Li, et al., Nat Commun, 2022)
为了证明globLoc在具有挑战性的样本上的表现,研究人员对线虫的联会复合体进行了比率三色3D成像(图5a)。单个的联会复合体可以在三维空间内清楚地分辨出来(图5b)。联会复合体的三种不同成分HTP-3、HIM-3和SYP-5的N端被很好地分离出来,没有明显的颜色串扰,并且这三种组分的空间排列与之前的研究非常吻合。
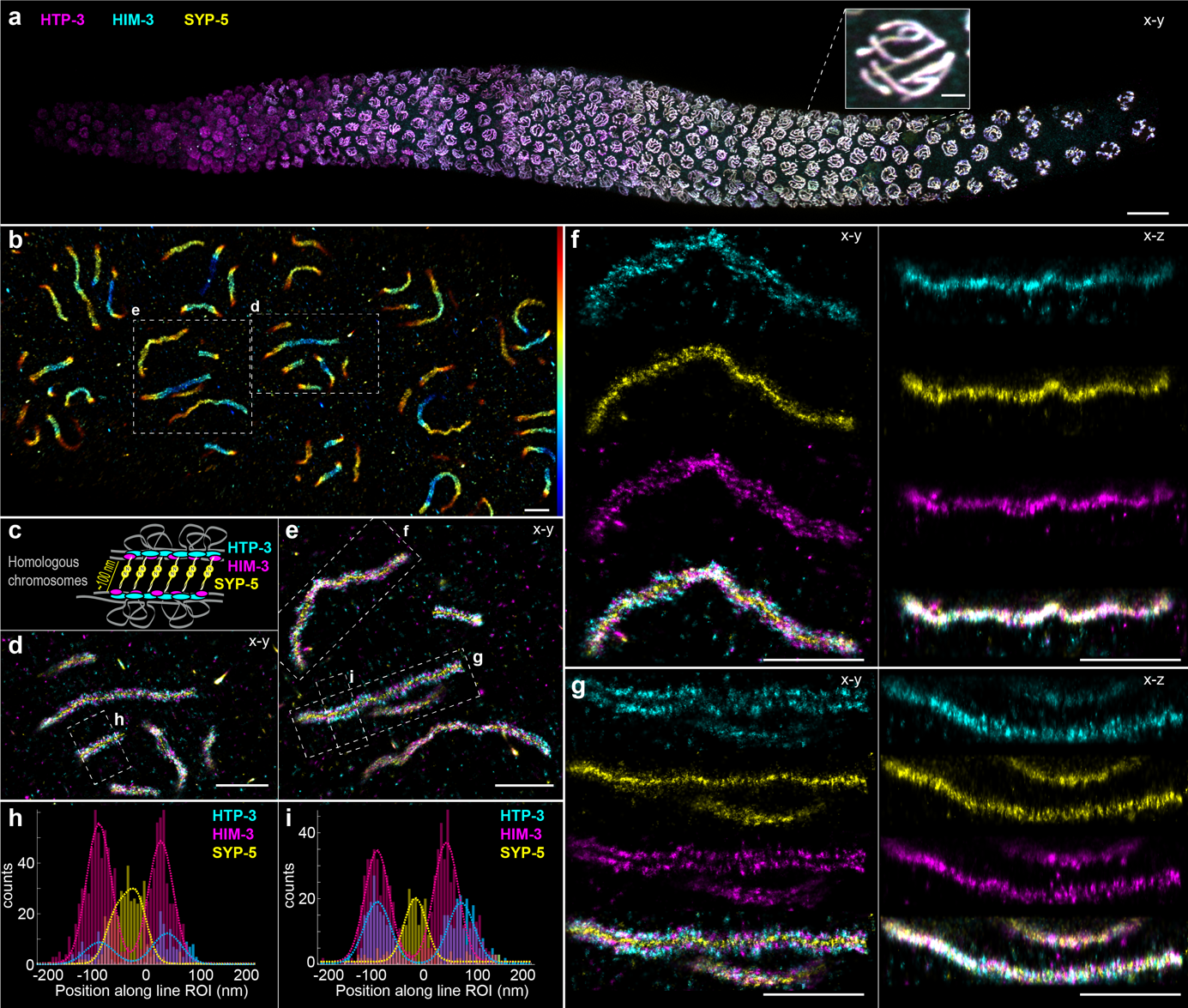
图5 globloc用于线虫联会复合体多色三维成像。
(图源:Yiming Li, et al., Nat Commun, 2022)
综上所述,研究人员证明了在多通道单分子定位过程中链接共享参数大大提高了定位精度,并减少了颜色分配串扰。globLoc不仅提高了定位精度,而且与单独拟合多个通道相比,还增加了拟合的鲁棒性。这一点很重要,因为信息被分成不同的通道,并且每个通道的信噪比(SNR)较差,这导致参数估计的误差很大。结果表明,globLoc可以在较大的轴向范围内精确地重建双平面和4Pi-SMLM数据,并在四种颜色同时成像时能进行准确地区分。基于深度学习的SMLM分析已被证明可以大大提高定位精度,特别是对于单分子密度较高的数据,然而,深度学习方法依赖于训练有素的网络,这些网络需要针对不同的成像条件(如不同的信噪比)进行再训练。对于多通道数据分析,由于不同的成像模式(如双平面、比率多色)需要采用不同的参数链接方案,因此情况要复杂得多。因此,基于深度学习的方法非常适合于单通道高密度单分子数据,而全局分析法将成为多通道标准密度数据分析的首选方法。
原文链接:https://www.nature.com/articles/s41467-022-30719-4
参考文献:
1. Bossi, M. et al.Multicolor far-field fluorescence nanoscopy through isolated detection of distinct molecular species. Nano Lett. 8, 2463–2468 (2008).
2.Mund, M. et al.Systematic Nanoscale Analysis of Endocytosis Links Efficient Vesicle Formation to Patterned Actin Nucleation. Cell 174, 884–896 (2018).
3.Zhang, Y. et al.Nanoscale subcellular architecture revealed by multicolor three-dimensional salvaged fluorescence imaging. Nat. Methods 17, 225–231 (2020).
4.Zhang, Z., Kenny, S. J., Hauser, M., Li, W. & Xu, K. Ultrahigh-throughput single-molecule spectroscopy and spectrally resolved super-resolution microscopy. Nat. Methods 12, 935–938 (2015).
5.Juette, M. F. et al.Three-dimensional sub–100 nm resolution fluorescence microscopy of thick samples. Nat. Methods 5, 527–529 (2008).
6.Babcock, H. P. Multiplane and spectrally-resolved single molecule localization microscopy with industrial grade CMOS cameras. Sci. Rep. 8, 4–11 (2018).
7.Jia, S., Vaughan, J. C. & Zhuang, X. Isotropic three-dimensional super-resolution imaging with a self-bending point spread function. Nat. Photonics 8, 302–306 (2014).
8.Dasgupta, A. et al.Direct supercritical angle localization microscopy for nanometer 3D superresolution. Nat. Commun. 12, 1180 (2021).
9.Cabriel, C. et al.Combining 3D single molecule localization strategies for reproducible bioimaging. Nat. Commun. 10, 1–10 (2019).
10.Shtengel, G. et al.Interferometric fluorescent super-resolution microscopy resolves 3D cellular ultrastructure. Proc. Natl. Acad. Sci. 106, 3125–3130 (2009).
11.Huang, F. et al.Ultra-High Resolution 3D Imaging of Whole Cells. Cell 166, 1028–1040 (2016).
12.Chen, L. et al.Advances of super-resolution fluorescence polarization microscopy and its applications in life sciences. Comput. Struct. Biotechnol. J. 18, 2209–2216 (2020).
13.Li, Y. et al. Real-time 3D single-molecule localization using experimental point spread functions. Nat. Methods 15, 367–369 (2018).
14. Li, Y. et al. Accurate 4Pi single-molecule localization using an experimental PSF model. Opt. Lett. 45, 3765 (2020).

第一作者及共同通讯作者李依明(前排中间)
(照片提供自:李依明实验室)
作者简介:
李依明,2009年于上海交通大学获生物医学工程系学士,2010年获海德堡大学医学物理硕士,2015年获卡尔斯鲁厄理工学院博士学位(导师: Uli Nienhaus 教授)。之后获得EMBL-玛丽居里博士后奖学金,在欧洲分子生物学实验室总部和耶鲁大学任职博士后研究员和访问学者(2016-2019)。现为南方科技大学生物医学工程系副教授,博士生导师。长期致力于研究三维超高分辨显微成像技术及其生物应用,在光学仪器研发,光学理论和成像算法等方面积累了坚实的理论基础以及实验经验。迄今,以第一/通讯作者在Nature Methods、Nature Communications、Optics Letters等国际权威期刊发表多篇论文,入选“深圳市海外高层次人才B类”,并长期担任Nature Methods、 Light: Science & Applications、Optics Letters等期刊的审稿人。目前和包括来自EMBL,耶鲁大学,牛津大学和剑桥大学等多个实验室有合作关系。此外,课题组长期招收博士后、研究助理及博士/硕士研究生,有物理,光学工程、计算机、机械工程、生物医学工程、生物技术、生物化学等相关专业背景,要求具备良好的学习能力、独立工作能力和团队沟通能力。有意者请将个人简历发送至李依明副教授邮箱:liym2019@sustech.edu.cn.
撰文︱李依明、石伟
责编︱王思珍