近日,南方科技大学生物医学工程系副教授李凯课题组在《德国应用化学》(Angewandte Chemie International Edition,IF:12.257)发表题为“受体工程化调控光敏剂ROS生成诱导巨噬细胞向M1极化用于光动力免疫治疗(Acceptor Engineering for Optimized ROS Generation Facilitates Reprogramming Macrophages to M1 Phenotype in Photodynamic Immunotherapy) ”的研究论文,并被遴选为“Hot Paper”。
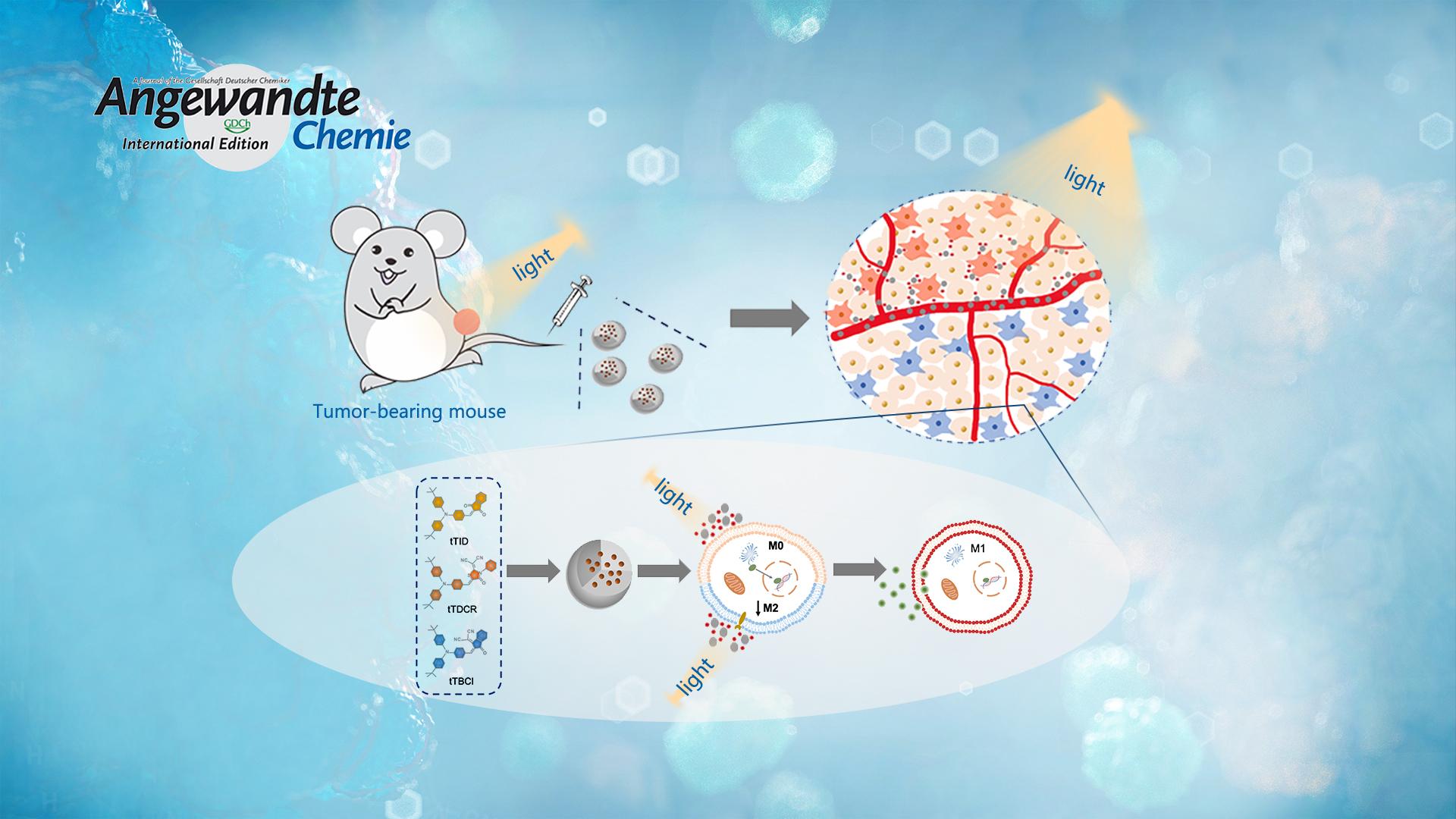
肿瘤微环境的免疫抑制作用极大程度限制了现有的肿瘤免疫疗法。而通过光动力治疗(PDT)将肿瘤相关巨噬细胞(TAMs)重编程为抗肿瘤的M1表型是克服肿瘤微环境免疫抑制作用和促进肿瘤免疫治疗的有效策略。然而,I型或II型PDT机制与TAMs极化效应之间的关系尚有待于进一步研究。为解答这一问题,李凯课题组通过改变D-A构型光敏剂的电子受体,实现对I型光敏剂ROS产率的调控。同时研究结果发现,该光敏剂主要通过I型PDT机制诱导TAMs极化,从而逆转肿瘤微环境中的免疫抑制作用。

图1. 光敏剂体外诱导巨噬细胞极化及其分子机制研究
研究人员首先通过分子调控合成三种具有不同ROS产生效率的D-A构型的光敏剂tTBCI,tTID和tTDCR,其ROS产生效率依次升高,并具有聚集增强ROS产生的能力。实验发现,I型机制产生的胞外ROS能够将M0和M2型巨噬细胞诱导成M1型,并且具有最高ROS产生效率的分子tTDCR NPs效果最好,且这一作用是通过激活巨噬细胞内NF-κB信号通路实现的。而在相同实验条件下,II型商业化光敏剂孟加拉红(RB)产生的胞外ROS未显示出诱导巨噬细胞向M1型极化的作用。

图2. 光敏剂通过诱导肿瘤相关巨噬细胞极化抑制小鼠体内肿瘤生长
体内实验进一步证实,该I型光敏剂tTDCR NPs能够通过诱导肿瘤组织内的M2型巨噬细胞极化为M1型,从而实现几乎完全抑制小鼠4T1皮下瘤生长。而在清除肿瘤组织内的巨噬细胞后,tTDCR NPs抑制肿瘤生长的作用被逆转。
综上所述,该I型光敏剂不仅可以逆转肿瘤微环境的免疫抑制作用,还有望克服肿瘤部位缺氧的限制,无需借助其它免疫佐剂即可实现对缺氧肿瘤组织进行精准高效的PDT-免疫治疗,具有巨大的应用潜力。同时,这一研究也为设计可激活巨噬细胞的新型光敏剂分子提供了参考,并为理解巨噬细胞活化在光动力免疫治疗过程中的工作原理提供了新的见解。
李凯课题组成员、博士后杨光为文章第一作者,李凯为通讯作者,南方科技大学为论文唯一通讯单位。该项研究获得国家自然科学基金面上项目、广东省引进创新创业团队、深圳市科创委面上项目及高层次人才团队等项目的资助。
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202013228
供稿:生物医学工程系
文字:李凯 杨光
通讯员:肖然
主图设计:丘妍
编辑:杨奂彦